Оглавление |
Сопоставление результатов исследования БКР и ВП со сфинктера ануса при ТВМС у детей с миелодисплазиями и нарушениями развития психоневрологических функций
Скворцов И.А., Блистанов А.Г.
Многообразные синдромы нарушения развития психоневрологических функций (НРПНФ) по их нозологической принадлежности можно отнести в три группы:
- детский церебральный паралич (ДЦП), перинатальная энцефалопатия (ПЭП) и другие структурные и функциональные изменения ЦНС, связанные с неблагополучием во внутриутробном, родовом и раннем постнатальной периодах;
- наследственные заболевания и хромосомные синдромы, манифестирующие НРПНФ;
- нейродисплазии, которые могут быть обусловлены как с генетической патологией, так и мультифакториальным поражением ЦНС на ранних стадиях внутриутробного периода.
Структурные нарушения в мозге в течение перинатального и раннего постнатального периодов проявляются в последующем нейроонтогенезе задержкой или аномалией структурного и функционального созревания.
Термин «нейродисплазия» объединяет широкий круг болезней развития нервной системы и включает внешне явные пороки развития (краниальные и спинномозговые грыжи, гидроцефалию, микроцефалию и др.); аномалии развития нервной системы, визуализированные при КТ и МРТ (гипоплазии коры и белого вещества полушарий мозга, мозолистого тела, ствола мозга, червя мозжечка, аномалии Денди-Уокера, Арнольда-Киари и др.); кроме того, – чисто клинические неврологические синдромы, включающие миелодисплазии и энцефаломиелодисплазии, стволовые дисплазии типа Мебиуса и др.
Так называемые «тканевые пороки развития», связанные с нарушениями морфогенеза на внутриорганном (тканевом и клеточном) уровне, проявляются нарушением структуры, уменьшением размеров тканевых образований, а в клинике – задержкой или замедлением темпов развития нервно-психических функций. Макроморфологические изменения структур нервной системы нередко отсутствуют, а функциональный дефицит обусловлен в разной степени выраженными микроморфологическими отклонениями в развитии и размещении в мозге тел самих нейронов, их аксона и дендритов, синаптических межнейрональных контактов, а также глиальных структур.
Среди нарушений микроструктурного развития головного и спинного мозга различают дисгенезии – нарушения нормального развития мозга под влиянием генетических или средовых факторов, дисплазии – структурное следствие дисгенезии на уровне ткани или органа, дистопии – вариант дисгенезии и дисплазии в виде аномальной по направлению миграции нейрональной ткани, а также дисхронии. Дизнейроонтогенетическая нейродисплазия может быть органной (структурной) с патологией головного мозга, спинного мозга, мозолистого тела, червя мозжечка и т.п., а также тканевой или клеточной.
Иными словами, нейродисплазия (или нейродисгенезия) может проявляться в виде структурной и функциональной аномалии развития нейронов, их микроструктур и органелл, отростков, синапсов, миелиновых оболочек, глиальной ткани, в виде отклонений от нормативного, генетически детерминированного размещения их в мозге, нарушений количественной и качественной характеристик образованных ими связей, не соответствующих генетической программе. Нейродисплазия чаще ограничивается функционально интегрированными структурными образованиями, что определяет клинически манифестный функциональный дефицит и процессуальность его становления.
В литературе термины «дисгенезии» (дисгенезис) и «дисплазии» используются в равной степени и практически как синонимы (Garaizar Axpe C. et al., 1998; Marin-Padilla M., 1999; Sebir G. et al., 1996 и др.). Наибольшее число работ посвящено корковой дисплазии (Onuma A. et al., 1997; Bartolomei F. et al., 1999), ее сочетаниям с дисплазией таламо-стриарных структур, с гетеротопией подкоркового серого вещества, гетеротопией перивентрикулярного узелкового серого вещества (Bartolomei F. et al., 1999; Sebir G. et al., 1996), с дисплазиями ствола мозга (Hamaguchi H. et al., 1993; Lipson A.H. et al., 1996). Исследования базируются преимущественно на данных клиники и результатах МРТ-мозга. Морфологически корковые дисплазии проявляются агирией, пахигирией, полимикрогирией, гетеротопией, а клинически дети могут наблюдаться с диагнозами: ДЦП, детский аутизм, эпилепсия, микроцефалия, мышечная дистрофия Фукуямы, синдромами Дубовица, Уокера-Варбурга и др.
При дизрафических синдромах, пороках развития нервной трубки диспластические явления могут быть системными и касаться перивентрикулярной области (ПВО) головного мозга и вертикальной области спинного мозга, окружающей центральный канал. В этих случаях дисплазия ПВО сопровождается нештатным изменением ее ростовой матричной роли, и, как правило, дополняется на более поздних этапах развития плода дизнейроонтогенетическими явлениями, в виде дискоординации миграции нейронов и глиальных элементов, нарушения процессов их функционального созревания и образования межклеточных объединений, а также недостаточностью трофического и иммунного обеспечения мозговых структур. Это косвенно подтверждается данными C. Garaizar Axpe с соавт. (1998), согласно которым причинами развития корковой дисплазии (по данным МРТ) могут быть, наряду с генетическими факторами, – внутриутробная гипоксия и асфиксия в родах.
В группу нейродисплазий входят:
- церебральные формы нейродисплазий (энцефалодисплазии): гидроцефалия, микро- и макроцефалии, краниостеноз, черепно-мозговые грыжи, краниоспинальные аномалии; аномалии развития головного мозга (анэнцефалия, прозэнцефалия, лиссэнцефалия, порэнцефалия, односторонняя или билатеральная шизэнцефалия, вентрикуломегалия и др.), гипер- или гипоплазии отдельных мозговых структур - мозолистого тела, червя мозжечка, ствола мозга (синдром Денди-Уокера и др.), дисплазии в пределах отдельных функциональных систем, в частности, дисплазии ядер черепномозговых нервов (синдром Мебиуса и др.);
- миелодисплазии различной степени выраженности – от морфологически выраженных спинномозговых грыж до структурно негативных чисто клинических и нейрофизиологических проявлений, сочетающихся с высокой насыщенностью МАР – случаи энуреза и энкопреза, трофических, сенситивных и двигательных нарушений со стороны нижних конечностей, тазового пояса и др.;
- энцефаломиелодисплазии, при которых, могут преобладать как явления энцефалодисплазии, так и миелодисплазии.
В предыдущей нашей работе, касающейся проблемы нейродисплазий (Скворцов с соавт., 2001), мы ограничивали группу нейродисплазий лишь грубыми проявлениями энцефаломиелодисплазии у пациентов, проходивших лечение в центре: 68 больных - с миелодисплазиями и энцефаломиелодисплазиями; 26 – со спинномозговой грыжей, 24 – с синдромом Денди-Уокера и изолированной гипоплазией червя мозжечка; 24 – с гипоплазией мозолистого тела, изолированной или в сочетании с гипоплазией червя мозжечка, 17 – с гипо- или гиперплазией ствола мозга, 6 - с синдромом Мебиуса; 67 – с гидроцефалией; 435 – с микроцефалией, 2 – с макроцефалией при синдроме Сотоса.
Однако накопление результатов сопоставления клинического синдрома с данными КТ- и МРТ-исследования головного и спинного мозга у детей с различными нарушениями нервно-психического развития (ДЦП, детский аутизм, задержки перцептивного, интеллектуального и речевого развития и др.) показали, что явления энцефаломиелодисплазии, в той или иной степени выраженные, всегда присутствуют у таких больных. Так, при клинически очерченном детском церебральном параличе (ДЦП), отмечено высокое насыщение малыми аномалиями развития (МАР), что свидетельствует о диспластических чертах у этих детей и связано с принадлежностью ДЦП к болезням нарушения развития нервной системы (в частности, вследствие характерного для него поражения перивентрикулярной области). Нельзя исключить и обратную зависимость: при ДЦП, сочетающемся с высокой насыщенностью МАР, ранимость ПВО может быть генетически обусловленной, так же, как и сами МАР.
По-видимому, при ДЦП всегда в той или иной степени присутствуют явления энцефаломиелодисплазии, как проявления дизнейроонтогенеза, о чем свидетельствуют нередкие находки при КТ мозга различных вариантов дистопий серого вещества в перивентрикулярной области, а также и другие структурные проявления нейродисплазии. По данным M.Marin-Padilla (1999) при перинатальных энцефалопатиях и ДЦП на фоне первичного гипоксического и травматического поражения мозга в непораженных структурах коры развиваются прогрессирующие структурные изменения, расцениваемые автором как вторичная приобретенная корковая дисплазия, которая и определяет процессуальность клинических неврологических проявлений в виде эпилепсии, нарушений интеллектуально-речевого развития и др.
Практически у всех наших больных с ДЦП отмечались гипоплазия передних отделов лобных и височных долей полушарий мозга, изменения перивентрикулярного белого вещества с явлениями дисмиелинизации и повышенной его гидрофильности, гипоплазии мозолистого тела, ствола мозга, червя и полушарий мозжечка, дисплазии коры полушарий мозга и коры мозжечка. Это обусловлено тем, что нарушение структурного развития мозга может быть связано не только с генетически детерминированными аномалиями, но и с вредоносными воздействиями в ранних стадиях нейроонтогенеза, когда формообразование ЦНС еще не завершено и программа структурного созревания мозга может нарушиться. Анализируя морфологическую картину по данным МРТ мозга, можно с определенной степени точности сказать, с патогенным воздействием на каком этапе внутриутробного, натального или раннего постнатального периодов связана нейродисплазия (внутриутробная нейроинфекция, гипоксия плода, черепная или спинальная травмы и др.).
Разграничение нейродисплазий в значительной степени определяется структурными изменениями в ЦНС, выявленными при рентгеновской и магнитно-резонансной компьютерной томографии головного и спинного мозга. Нами проанализировано 1692 компьютерных и магнитно-резонансных томограмм головного мозга детей, проходивших лечение в НТЦ ПНИ в связи с нарушением развития психоневрологических функций при ДЦП и других врожденных и наследственных заболеваниях нервной системы. Ранее нами уже были отмечены основные варианты морфологических изменений в мозге у этих детей (Скворцов И.А., 1995), описаны структурные нарушения со стороны желудочков мозга, перивентрикулярного белого вещества и коры.
Таким образом, структурные признаки нейродисплазии являются постоянной нейровизуальной манифестацией у детей с клиникой нарушения развития психоневрологических функций. Основные КТ и МРТ-проявления нейродисплазии можно отнести в несколько групп.
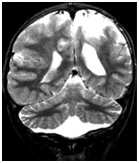
I. Корковая дисплазия или гипоплазия, которая в большей части случаев касается передних отделов лобных и височных долей. Реже отмечается гипоплазия затылочных долей. К этой группе относились и случаи с изменениями структуры борозд и извилин в виде микро- и макрогирии, лиссэнцефалии и др. (рис. 1).
Принятый термин “корковая атрофия”, который нередко применяется в таких случаях, нельзя считать правильным, поскольку речь идет не о прогрессирующем уменьшении объема долей мозга, а об относительно стационарном состоянии, обусловленном не атрофией (с прогрессирующим уменьшением объема коры мозга), а именно гипоплазией (дизнейроонтогенезом, нарушением, недостаточностью формообразования).
Рис. 1. Корковая дисплазия, расширение боковых желудочков, гипоплазия червя мозжечка у ребенка Владислава Е., 7 лет, со спастико–гиперкинетической формой ДЦП, сенсомоторной дисфазией развития.
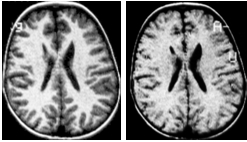
II. Корковая дисплазия или дистопия, которая при КТ-исследовании мозга преимущественно проявляется нарушением дифференциации серого и белого вещества полушарий, или дистопией серого вещества в «желудочковую сторону» перивентрикулярной области мозга в связи с нарушением нейрональной миграции (рис. 2). При этом макроморфологических признаков гипоплазии или атрофии мозга может не быть.
>Рис. 2. Дистопия серого вещества в перивентрикулярной области мозга у ребенка Ксении К., 6 лет с эпилептическими проявлениями на фоне гипертензионно-гидроцефального синдрома.
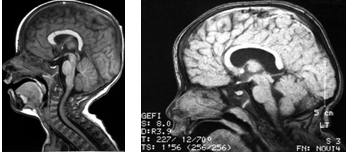
III. Гипоплазия мозолистого тела, отражающая нарушения созревания межполушарных взаимодействий, проявлялась в нескольких вариантах: а) полное отсутствие мозолистого тела (рис. 3А); б) локальная гипоплазия того или иного отдела мозолистого тела, чаще в зоне, соответствующей задним отделам лобных и теменным долям (рис. 3Б); в) дисплазия при отсутствии гипоплазии, в виде равномерной толщины дугообразно расположенного мозолистого тела без четкой дифференциации его на передние и задние отделы (рис. 4 а,б). Гипоплазия мозолистого тела нередко сочеталась с гипоплазией червя мозжечка и\или ствола мозга (рис. 5А).
Рис. 3. А. Аплазия мозолистого тела, гипоплазия червя мозжечка у ребенка Асият Б., 5 лет с атонически-астатической формой ДЦП, задержкой психоречевого развития. Б. Гипоплазия мозолистого тела у ребенка Махсада С., 4 лет со спастической формой ДЦП, задержкой психоречевого развития.
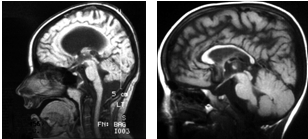
Рис. 4. Дисплазия мозолистого тела с отсутствием его дифференциации на отделы. а) ребенок Миша Т., 1 год с синдромом энцефаломиелодисплазии, дистонической формой ДЦП, аутистическим синдромом. б) ребенок Люба Н., 3 лет с нарушением развития психоречевых и коммуникативных функций.
IV. Гипоплазия червя мозжечка, характеризующаяся его малыми размерами на сагиттальном срезе, огрублением извилин, резким увеличением объема большой цистерны (рис. 5Б). В ряде случаев гипоплазия червя мозжечка сопровождалась гипоплазией его полушарий. В случаях КТ-позитивного синдрома Денди-Уокера гипоплазия червя мозжечка сочеталась с вентрикуломегалией, гипоплазией мозолистого тела, реже - и ствола мозга.
Рис. 5. А. Сочетание гипоплазии мозолистого тела с гипоплазией червя мозжечка и ствола мозга у ребенка Ани С., 10 мес. с хромосомной перестройкой по 11 паре, спастико-атактическим синдромом. Б. Гипоплазия червя мозжечка у ребенка Гванцы Д., 2 лет с атонически-астатической формой ДЦП.
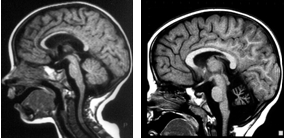
Рис. 6. Гипоплазия ствола мозга в сочетании с гипоплазией червя мозжечка и мозолистого тела: а) у ребенка Инги Х., 2 лет с атонически-астатической формой ДЦП, эпилептическим и аутистическим синдромами, б) у ребенка Антона Л., 13 лет с мозжечковой формой ДЦП.
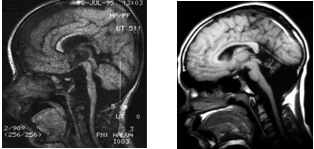
V. Дисплазия ствола мозга при КТ-исследовании проявлялась в виде гипоплазии с уменьшением размеров продолговатого мозга и варолиева моста, что могло быть компонентом синдрома Денди-Уокера (рис. 6 а,б), реже в виде гиперплазии с увеличением поперечных размеров продолговатого мозга, в меньшей степени варолиева моста (рис. 7 а,б,в). В основе обоих вариантов лежит нарушение формообразования сегментарных структур ствола – ядер черепных нервов, ретикулярной формации, олив и др. Могут наблюдаться и другие проявления дисплазии, например, аномалии развития ствола в виде формирования в нем дополнительных полостей-кист (рис. 8а).
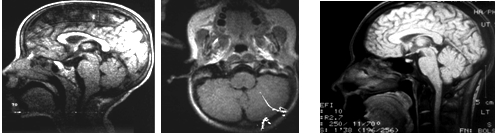
Рис. 7. Гиперплазия продолговатого мозга и варолиева моста: а, б – у ребенка Саши М., 3 лет с нарушениями статико-моторного и психоречевого развития, в – у Эдуарда Б., 19 лет с корково-стволо-мозжечковой недостаточностью, денто-рубральным тремором, эпилептическим синдромом.
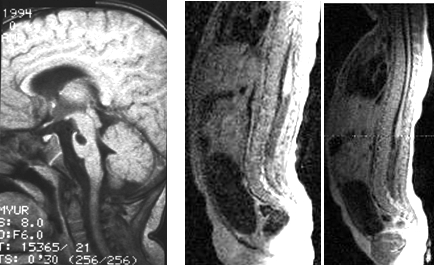
7. Миелодисплазия (включая спинномозговые грыжи), чаще определялась в терминальном отделе спинного мозга в виде уменьшения в размерах поясничного утолщения или кистообразования в области конуса (рис. 8б) и других проявлений.
Рис. 8: а) врожденная киста варолиева моста у ребенка Никиты М. 1 г. 6 мес. со спастической формой ДЦП, б) дисплазия шейного отдела спинного мозга у ребенка Валерии Е., 8 мес. с клиникой правостороннего монопареза ноги, тазовыми нарушениями.
:
***
Среди других форм нейродисплазий относительно обособленное место и по клинике, и по морфологии занимают миелодисплазии. Термин «миелодисплазия» отражает нарушение формообразования и функционирования структур спинного мозга, вследствие его дисгенезии. В литературе обсуждается спорность представлений об исключительно внутриутробном происхождении миелодисплазии. Спинной мозг к моменту рождения является онтогенетически зрелым отделом ЦНС, но его развитие не прекращается. Возникновение миелодисплазии, как синдрома, обусловлено следующими основными процессами:
- трансформацией функционального взаимодействия в интернейрональных срединных структурах спинного мозга с углублением межсегментарной интеграции, протекающих на фоне созревания надсегментарных структур головного мозга и адаптации спинального сегментарного аппарата к появлению новых нисходящих влияний;
- относительным смещением вверх каудального отдела спинного мозга, темп роста которого отстает от темпов роста позвоночника, что требует адекватного развития сосудистой системы, эластичности и пластичности соединительнотканных элементов и корешков спинного мозга в позвоночном канале.
- сочетание и взаимообусловленность миелодисплазии и перинатальной миелопатии определяют выраженный полиморфизм клинических проявлений спинальной недостаточности, а также различные сроки клинической манифестации. Внутриутробно сформировавшаяся миелодисплазия определяет повышенную ранимость спинного мозга в перинатальном периоде, а неблагоприятные перинатальные факторы препятствуют нормальному постнатальному созреванию спинного мозга (Скворцов И.А., 2000; Шаховский В.А., Скворцов И.А., Харина Г.В., 1987).
Нарушение указанных процессов может привести к функциональной миелодисплазии, обусловленной не количественным дефицитом спинальных нейронов, а их качественно аномальным формированием, незрелостью, недостаточностью дендритного дерева и межнейрональных связей. Функциональные нарушения при миелодисплазии, как правило, не связаны только со спинным мозгом. В большинстве случаев нейродисплазия имеет более или менее генерализованный характер, охватывая одновременно структуры и головного, и спинного мозга (особенно его каудального отдела).
Двигательные, сенситивные и трофические нарушения при миелодисплазии вариируют по характеру, степени выраженности и обусловливаются как явными аномалиями развития головного и спинного мозга (напр., при черепномозговой или спинномозговой грыжах), так и менее очевидными, косвенными «диспластическими» признаками которых являются, в частности, уже отмеченные малые аномалии развития (МАР), как множественные, так и локальные (местные), обычно имеющие метамерное отношение к соответствующему сегменту головного и спинного мозга (напр., дермальный синус в межягодичной области или рентгенопозитивные изменения в позвоночнике типа spina bifida cystica et occulta).
В Научно-терапевтическом Центре по профилактике и лечению психоневрологической инвалидности (НТЦ ПНИ) в течение 20 лет наблюдалось более 7 тысяч детей, поступивших в связи с нарушениями развития двигательных, перцептивных, речевых, интеллектуальных и коммуникативных функций, обусловленных врожденными и наследственными заболеваниями нервной системы. Среди детей с нейродисплазиями наблюдались 99 больных с миелодисплазией, в том числе 32 с последствиями оперированной спинномозговой грыжи.
У детей миелодисплазией наблюдались расстройства чувствительности преимущественно в ногах по сегментарному или сегментарно-периферическому типу, а также вялые парапарезы с атрофий мышц тазового пояса и ног, вторичными скелетными деформациями, резкое снижение или отсутствие кожных (брюшных, анальных, ягодичных) и сухожильных рефлексов с ног. У 67 детей миелодисплазия сочеталась с выраженным нарушением функций тазовых функций, энурезом и/или энкопрезом. Наиболее грубые нарушения тазовых функций наблюдались у детей со спинномозговми грыжами поясничной или нижне-грудной локализации – в виде истинного или периодического недержания мочи и кала, зияния ануса, выпадения прямой кишки, трофическими нарушениями со следами пролежней.
В отличие от энуреза при грубых спинальных нарушений, у больных с спинномозговыми грыжами, который обычно сопровождался и энкопрезом, и атрофией мышцы сфинктера ануса, у большей части детей с миелодисплазиями энурез чаще наблюдался в изолированном виде и носил функциональный характер, хотя в его основе как правило, лежала структурная незрелость спинальных центров управления тазовыми функциями. У таких детей наблюдалось ночное недержание мочи, реже – дневное упускание, иногда с элементами энкопреза. Выявлялась разной степени выраженности дисфункция мочевыделения - от ежедневных (ночных и дневных) до отдельных, но повторных (при увлечении игрой или эмоциональных реакциях) эпизодов упускания мочи. Эти явления могли отмечаться не только как самостоятельный синдром, но нередко определялись и у детей с различными формами ДЦП, детским аутизмом, умственной отсталостью, двигательной расторможенностью с дефицитом внимания.
В 75,7% случаев миелодисплазия у обследованных детей сочеталась с ДЦП (49,96% из них – спастические формы, 4,28% – гиперкинетические, 21,42% – атонические и атонически-атактические формы); в 5,71% – с различными аномалиями развития (синдромы Денди-Уокера, Арнольда-Киари и др.); в 49,96% – наблюдались умственная отсталость, нарушения интеллекта, речи, дефицит внимания, эмоционально-волевые расстройства, аутистические проявления, эпилептический синдром, шизотипическое развитие личности и др. психические отклонения.
Все дети с миелодисплазией прошли повторные курсы комплексной стимуляции статикомоторных и психоречевых функций, включающей медикаментозное лечение с микроинъекционным или безыгольным введением биологически активных препаратов (БАП) по невромерным, миомерным и склеромерным зонам, массаж, ЛФК, форсированную сенсорную стимуляцию основных анализаторных систем, физиотерапевтические воздействия, коррекционные психологические, педагогические и логопедические занятия (Скворцов И.А. с соавт., 1989; Скворцов И.А., 1993, 1997, 2000).
При миелодисплазии, спинномозговых грыжах, сопровождавшихся нарушениями тазовых функций, метамерная фармакотерапия охватывала зону промежности с сочетанным невромерным и склеромерным введением (БАП) гидролизатов мозга (церебролизин, церебролизат) и актовегина по ходу срамных нервов, а также миомерным их введением по окружности ануса. При вялых нижних парапарезах и мышечных атрофиях проводилась соответствующая стимулирующая метамерная терапия с введением препаратов, улучшающих нервную и нервно-мышечную проводимость и трофику мышц (гидролизаты мозга, актовегин, глиатилин, нейромидин, дибазол и др.), а также гомеопатические препараты (дискус композитум, плацента композитум, цель Р, коэнзим композитум, убихинон композитум).
Одновременно проводилась электростимуляция атрофичных мышц голеней и анального сфинктера. Стимулирующий электрод помещали в середине между анусом и окончанием копчика с визуальной регистрацией активности сокращения анального сфинктера. Кроме того, стимулировали область, соответствующую поясничному утолщению спинного мозга, как электрическими стимулами, так и магнитными (трансвертебральная магнитная стимуляция – ТВМС).
***
Термографическое исследование, основанное на регистрации инфракрасного излучения тела человека, при миелодисплазиях дает возможность определять сегментарные нарушения инфракрасного излучения на поверхности человеческого тела (Мирошников М.М., 1981; Ройтман Г.В., 1995; Brett E.M., 1983; Schule K., 1985). Преимуществом термографии является безвредность и безболезненность, возможность динамического наблюдения и высокая информативность, что позволяет широко использовать ее в повседневной неврологической практике. Термографическое исследование проводилось на компьютеризированном тепловизоре «Радуга ТВЦ-1» (диапазон 36-370 ИК-излучения). Компьютерная база данных исследований позволяет накапливать материал и обрабатывать его. Больные обследовались в динамике на фоне повторных курсов лечения в НТЦ ПНИ, всего обследовано более 3 тыс. больных.
У больных с миелодисплазией при спинномозговой грыже термографическое исследование позволяет получить дополнительную информацию о функциональном состоянии сегментарной иннервации в зоне аномального структурного развития нервной системы (рис. 9). Обследованно 28 пациентов в возрасте от 6 мес. до 15 лет с оперированной спинномозговой грыжей пояснично-крестцового отдела и неврологическими нарушениями в виде вялого пареза и анестезии нижних конечностей, нарушений мочеиспускания и дефекации по периферическому типу (парез и атрофия сфинктеров уретры и ануса). При обследовании каждого больного были взяты симметричные зоны в области верхних и нижних конечностей, лица, туловища, живота и поясницы, а также промежности. На первом курсе лечения отмечалось резко выраженное снижение ИК-свечения в дерматомерах ниже уровня поражения спинного мозга с высокой термографической ампутацией нижних конечностей и отсутствием термографического контурирования ануса.
Рис. 9. Термограмма нижней части тела двух детей с миелодисплазией. Термоасимметрия со снижением температуры в дистальных отделах ног (симптом ампутации).
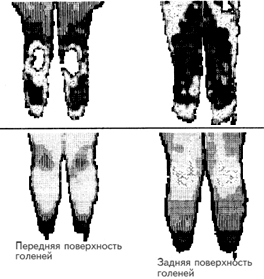
На фоне лечения отмечалось улучшение в состоянии больных в виде потепления стоп, повышения их чувствительности. Улучшение трофики и мышечной силы ягодичных мышц и мышц бедра и голени определяли появление движений в ногах или увеличение их объема. Начинали определяться коленные, а затем и ахилловы сухожильные рефлексы. В отдельных случаях дети начинали сидеть, появлялась опора на ноги. Уменьшались тазовые нарушения: истинное постоянное недержание мочи сменялось периодическим, появлялась возможность более или менее длительного удержания мочи. Улучшалась трофика и сила анального сфинктера, исчезало зияние ануса и выпадение прямой кишки, уменьшалось недержание кала. Анестезия сменялась гипестезией, повышалась чувствительность к инъекциям и электрическому раздражению.
При термографическом исследовании в динамике на фоне повторных курсов лечения в НТЦ ПНИ наблюдалось постепенное повышение ИК-излучения в области промежности, анус четко контурировался с расходящимися от него эллипсовидной формы кольцами по промежности, внутренней поверхности бедра и ягодичной области (феномен «красного ануса»). Чем шире и термографически «ярче» зона повышенного ИК-излучения в промежности и в ногах, тем более выраженное восстановление тазовых функций и двигательных возможностей со стороны нижних конечностей наблюдалось в клинике. Нередко термографические изменения опережали по выраженности, и как бы предшествовали клиническому и электромиографическому улучшению, что определяет их прогностическое значение.
Таким образом, клиническое, термографическое и электронейромиографическое исследования больных с миелодисплазией при спинномозговой грыже в динамике их лечения существенно дополняют друг друга и имеют большое диагностическое и прогностическое значение.
***
Электронейромиографии (ЭНМГ) принадлежит большая роль в диагностике различных вариантов нейродисплазий, главным образом, в связи с преобладанием в их клинике сегментарных нарушений. ЭНМГ позволяет получить объективные данные о динамике патологического процесса, его прогрессировании при развитии болезни или регрессировании и функциональном восстановлении на фоне успешного лечения больных.
В работах, опубликованных в 1987-1988 гг., нами совместно с Г.Б.Хариной, В.А.Шаховским, и Т.Н.Гусаровой анализировались клинико-электронейромиографические корреляции у детей с миелодисплазией и энурезом. При миелодисплазии, спинномозговых грыжах ЭНМГ-исследование нервно-мышечного аппарата нижних (в меньшей степени – верхних) конечностей выявляет денервационные нарушения, снижение амплитуд вызванных М-ответов и скоростей проведения
В таблице 1 представлены ЭНМГ-показатели в группах больных с миелодисплазией, с синдромом Денди-Уокера, микроцефалией в сравнении с атоническими и спастическими формами ДЦП. Как видно из таблицы, резких различий в величинах ЭНМГ-показателей между группами нет.
Вместе с тем, группе миелодисплазий показатели СПИэфф были ниже, чем у детей с синдромом Денди-Уокера, микроцефалией и спастической формой ДЦП. В этой же группе была самой низкой амплитуда М-ответа в зоне иннервации большеберцового нерва (при сопоставлении с обеими группами ДЦП (p < 0,05), что отражало компонент миелодисплазии в этой группе детей. При электронейромиографическом исследовании детей с последствиями оперированной спинномозговой грыжи отмечено резкое снижение амплитуды или полное отсутствие вызванных М-ответов, резкое замедление скоростей проведения импульса (СПИ) по большеберцовому и малоберцовому нервам. При синдроме Денди-Уокера и в группе детей с микроцефалией ЭНМГ-показатели были нормальными в руках и умеренно сниженными при исследовании большеберцового нерва.
Таблица 1. ЭНМГ-показатели у детей с миелодисплазиями, синдромом Денди-Уокера, микроцефалией и различными формами ДЦП.
ДИАГНОЗ |
Амплитуда спонтанной активности при максимальном напряжении (мкВ) |
Срединный нерв |
Большеберцовый нерв |
|||
Мышцы тенара |
Икроножная мышца |
СПИэфф (м/с) |
Амплитуда М-ответов (мкВ) |
СПИэфф (м/с) |
Амплитуда М-ответов (мкВ) |
|
Миелодисплазия |
1381,1±84,6 |
1434,2±75,7 |
62,1±1,9 |
5398,3±606,3 |
50,1±1,4 |
2790,0±500,6 |
Синдром Денди-Уокера |
1450,6±108,2 |
1192,8±114,0 |
67,9±2,6 |
6268,0±613,2 |
52,1±1,3 |
3767,0±651,4 |
Микроцефалия |
1329,6±97,3 |
966,3±66,3 |
64,2±1,4 |
5240,3±573,2 |
53,4±1,0 |
3391,3±545,0 |
ДЦП, атонические формы |
929,2±96,4 |
723,0±79,1 |
58,0±1,6 |
5279,4±492,5 |
50,0±1,5 |
4663,8±592,3 |
ДЦП, спастические формы |
1151,4±97,9 |
1190,9±96,4 |
64,0±1,3 |
6591,7±352,8 |
52,0±0,9 |
4798,5±640,8 |
Атоническая форма ДЦП выделялась из других групп и отличалась от группы спастической формы ДЦП более низкими показателями СПИэфф (для срединного нерва – p < 0,01) и амплитуд осцилляций при максимальном мышечном напряжении (в икроножных мышцах – p < 0,01), что отражает задержку созревания и миелинизации как центральных, так и сегментарно-периферических проводящих путей, характерную для этой клинической формы.
Рис. 10. Миелодисплазия у детей с оперированной спинномозговой грыжей. Увеличение амплитуды М-ответов при стимуляции большеберцового и малоберцового нервов на фоне лечения в НТЦ ПНИ.
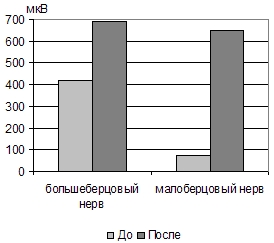
Электронейромиографическое исследование, проведенное в динамике курсового лечения в НТЦ ПНИ, выявляло положительные сдвиги, нередко опережавшие наступление клинического улучшения. Так, при миелодисплазии, оперированной спинномозговой грыже начинали регистрироваться М-ответы при стимуляции большеберцового и малоберцового нервов в проксимальных и дистальных точках, что позволяло определять СПИ. СПИ, первоначально резко сниженная, постепенно нарастала, хотя и не достигала нормальных величин. В тех случаях, когда удавалось зарегистрировать М-ответ и при первичном исследовании, на фоне лечения его амплитуда нарастала, однако, величина ее оставалась сниженной, по сравнению с нормой (рис. 10).
При миелодисплазиях, спинномозговой грыже пояснично-крестцовой локализации, наряду с ЭНМГ-исследованием нервно-мышечного аппарата конечностей и туловища, исследовался бульбокавернозный рефлекс (БКР), дававший дополнительную информацию о состоянии сегментарно-рефлекторной сферы на уровне пояснично-крестцовых сегментов спинного мозга. Стимулирующий электрод размещали на головке полового члена или клитора, а отводящий - в области мышцы наружного анального сфинктера. Стимуляция проводилась с частотой 2 имп/с в режиме усреднения до 100-200 стимулов. Определяли латентность, амплитуду и форму потенциала БКР. Латентность полученного потенциала БКР варьировала в пределах от 21 до 36 мс; в отдельных случаях она превышал 40 мс и даже достигала 55 мс.
В норме лишь выявляется четкий двухфазный потенциал. В некоторых случаях миелодисплазии определялся менее четкий полифазный низкоамплитудный волнообразный потенциал. Иногда потенциал БКР первоначально не вызывался, но появлялся при повторных сериях стимуляции (даже в течение одного исследования), вначале в виде полифазного потенциала, и лишь затем – двухфазного. Таким образом, на фоне повторных стимуляций форма, амплитуда и латентность БКР закономерно менялись.
Эффект стимуляции, определяемый в ходе исследования таких детей с энурезом, по-видимому, указывает на функциональный характер недостаточности спинальных центров мочеиспускания. Полифазность и растянутость потенциала БКР обусловлена асинхронностью деятельности сегментарных уровней спинного мозга, неспособных к реализации полноценного рефлекторного ответа. Вместе с тем это не органический дефект, а функциональная десинхронизация вследствие несформированности доминантного центра.
Повторная форсированная стимуляция насильственно вызывает синхронизацию, необходимую для нормального функционирования сегментарного рефлекторного аппарата спинного мозга. Она нормализует потенциалы БКР и, по-видимому, оказывает благоприятное воздействие на функциональные взаимоотношения пояснично-крестцовых сегментов соответствующих спинальных центров: постепенно происходит закономерная трансформация рефлекторного ответа: 1) уменьшение латентного периода, 2) повышение амплитуды и 3) переход от растянутого полифазного ответа к правильно сформированному двухфазному (рис. 11).
При наиболее тяжелых проявлениях миелодисплазии, выраженных спинальных нарушениях у детей с оперированной спинномозговой грыжей (при зияющем анусе, нередко с выпадением прямой кишки) в ряде случаев потенциал БКР не регистрировался. Невозможность зарегистрировать БКР у таких детей нередко обусловлена не только незрелостью или поражением сегментарных структур, но также и грубой дисплазией и атрофией мышцы анального сфинктера, не способной ответить на поступающие сигналы (рис. 12).
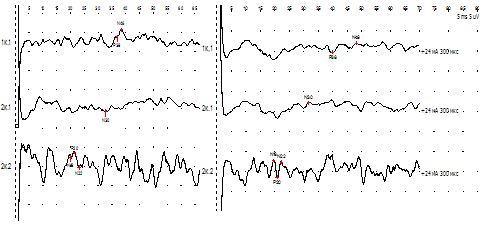
Рис. 11. Динамика «восстановления» потенциала БКР при повторных сериях стимуляции у 2-х детей с миелодисплазией и энурезом (А и Б). Повышение амплитуды, укорочение латентного периода, переход от полифазного к двухфазному (совместно с Г.Б. Хариной, В.А.Шаховским, Т.Н.Гусаровой, 1987, 1988).
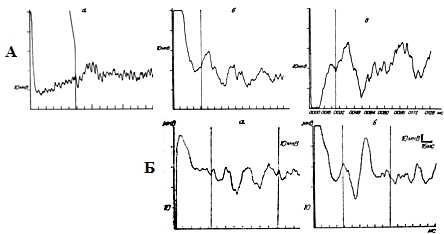
Рис. 12. Максим П. Миелодисплазия. Последствия оперированной спинномозговой грыжи. Отсутствие потенциала БКР.
Рис. 13. Фуад О. Миелодисплазия. Энурез. Динамика потенциала БКР на фоне терапии.
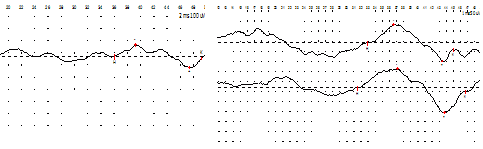
Рис. 14. Миелодисплазия у детей с оперированной спинномозговой грыжей. Увеличение амплитуды бульбокавернозного рефлекса (БКР) на фоне лечения в НТЦ ПНИ.
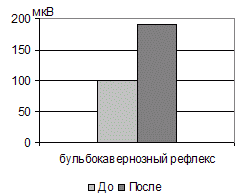
На фоне комплексной реабилитационной терапии, включающей метамерную фармакотерапию, повторное исследование бульбокавернозного рефлекса (рис. 13, 14) выявляло постепенное увеличение его амплитуды (или появление ранее не определявшегося потенциала БКР), однако, его форма нередко еще длительное время оставалась полифазной, что свидетельствовало о дискоординации функционирования и задержке интеграции сегментарных спинальных центров мочеиспускания и дефекации.
Одновременно проводилась транскраниальная и трансвертебральная магнитная стимуляция (ТКМС и ТВМС) с исследованием ВП анального сфинктера на магнитную стимуляцию коры мозга и поясничного утолщения спинного мозга. При магнитной стимуляции (МС) глубокое распространение индукционного тока воздействует на мембраны клеток, изменяя их заряд. Возникающее при этом возбуждение передается по нервным волокнам и вызывает сокращение гладкой мускулатуры. У больных с миелодисплазией и тазовыми нарушениями магнитная стимуляция, вызывая эфферентно направленные токи и мышечный ответ, позволяет определить степень поражения и дисфункцию уретральных и анальных сфинктеров малого таза. Данные ТКМС и ТВМС существенно дополняют результаты оценки сегментарных афферентных и эфферентных нервных волокон и мышц, достигаемые методами электронейромиографии.
Также как и при исследовании БКР при магнитной стимуляции для регистрации коркового и сегментарного ответа с мышц дна таза используют специальные пробковые поверхностные электроды (реже игольчатые). Обычно потенциал отводятся с m. sphincter ani externus реже – с m. sphincter urethrae. Кольцевой койл при корковой стимуляции располагают на черепе над точкой Cz. В отдельных случаях для получения ответа катушку смещают на 2 см кзади от Cz. Для получения адекватных ответов рекомендуется использовать стимул максимальной силы 2,0-2,5Т то есть 100% от мощности магнитного стимулятора. Регистрируемый мышечный потенциал имеет небольшую амплитуду и сложную форму. Для получения сегментарных ответов с мышц дна таза койл располагают по средней линии над областью проекции Ll или L4 позвонков. Сегментарные ответы имеют большую амплитуду и регистрируются уже при силе стимула 65-70% . Отведение вызванных ответов производят в состоянии покоя, а затем повторяют на фоне фасилитации – при произвольном сокращения мышц дна таза (рис. 15, 16).
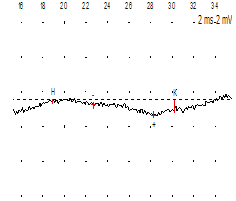
Как видно на рис. 15, ВП анального сфинктера на магнитную стимуляцию поясничного утолщения спинного мозга определяется даже тогда, когда потенциал БКР еще не регистрируется. На фоне терапии потенциал БКР стал определяться.
Характерно, что на фоне комплексной реабилитационной терапии уменьшение выраженности энуреза и энкопреза, появление, а затем и возрастание амплитуд вызванных ответов со сфинктера ануса при БКР и ТВМС наблюдались не только при функциональных тазовых нарушениях но и у больных со спинномозговыми грыжами при тяжелых исходных нарушениях функций и трофики тазовых органов. одновременное определение ТВМС и БКР предоставляет не только диагностические критерии, но может иметь и прогностическое значение в плане возможности восстановления тазовых функций, поскольку при наиболее тяжелой миелодисплазии амплитуда ВП анального сфинктера при БКР и ТВМС может существенно снижаться, а в отдельных случаях ВП БКР совсем не регистрируется.
Рис. 15. Андрей К. Миелодисплазия. Энурез. Диагностическая эффективность ТВМС. Слева – потенциалы БКР до лечения, и в центре – ВП с анального сфинктера при ТВМС, справа – потенциалы БКР после лечения.
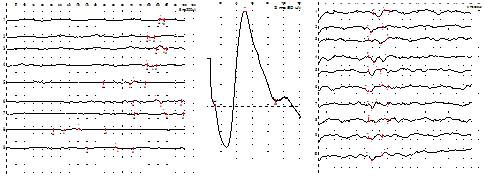
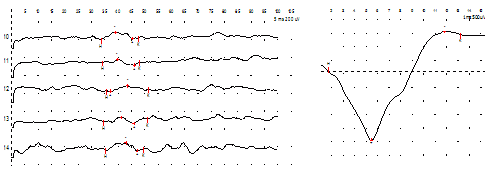
Рис. 16. Герман Г. Миелодисплазия. Энурез. Диагностическая эффективность ТВМС. Слева потенциалы БКР, справа – ВП с анального сфинктера при ТВМС.
При благоприятном эффекте реабилитационной терапии можно отметить несколько этапов восстановления ВП при БКР и ТВМС: 1) отсутствие ВП БКР и ТВМС, 2) появление ВП ТВМС при отсутствии ВП БКР, 3) нарастание амплитуды ВП ТВМС при отсутствии ВП БКР, 4) появление ответа БКР (чаще низкоамплитудного и полифазного), 5) нарастание амплитуды ВП БКР и трансформация его в двухфазный ответ, 6) регистрация ответов при БКР и ТВМС. Полное восстановление трофики сфинктера ануса и тазовых функций наступает несколько позже восстановления ВП и, если прекратить стимуляционную терапию, то возможен клинический и нейрофизиологический «откат» назад. поэтому после достижения ответов при БКР и ТВМС реабилитационную терапию необходимо продолжать до достижения устойчивого неснижаемого эффекта.
***
Использование магнитной стимуляции в лечении тазовых нарушений при миелодисплазии имеет несколько подходов: 1) прямая магнитная стимуляция промежности для неинвазивной тренировки мышц дна таза, при использовании которой воздействие оказывается на все анатомические структуры дна таза (мышцы, нервы); 2) лечебная ТВМС, прикоторой используются те же зоны стимуляции, что и при диагностической ТВМС. Интенсивность магнитного стимула подбирается индивидуально и соответствует наиболее комфортному ощущению для больного.
мы включили терапевтическую трансвертебральную магнитную стимуляцию на область поясничного утолщения (ТВМС) в комплексную реабилитационную терапию детей с миелодисплазиями, в том числе, с энурезом, последствиями оперированной спинномозговой грыжи. У части больных миелодисплазии сочетались с клиническими признаками ДЦП.
Приводим две выписки из историй болезни. В приведенных случаях на фоне терапии с применением ТВМС существенно улучшилось общее состояние больных, тазовые функции и трофика анального сфинктера, у одного из больных впервые появился бульбокавернозный рефлекс, а у другого – он стал более четким, наросла его амплитуда. Кроме того, на лечении впервые появились корковые ответы при исследовании соматосенсорных ВП с обеих сторон.
Ильсия Г. Поступила на первый курс лечения в возрасте 3 лет 6 месяцев. Диагноз: Внутриутробное поражение ЦНС. Порок развития головного и спинного мозга. Состояние после удаления спинномозговой грыжи поясничной локализации (менингомиелорадикулоцелле с перфорацией грыжевого мешка). Миелодисплазия. Нижний смешанный парапарез. Нарушение функции тазовых органов. Повышенная эластичность кожи. Из анамнеза: ребенок от первой беременности, у матери обнаружен вирус простого герпеса. Роды срочные, вес при рождении 3200, Апгар 7\8 баллов. На первые сутки жизни произведена операция иссечение спинномозговой грыжи. Раннее развитие: голову держит с 4 месяцев, сидит с 6 месяцев, начала ходить с 2 лет, фразовая речь с 1 года 5 месяцев.
В неврологическом статусе: в сознании, активная, контактная. Менингеальных знаков и судорог нет. ЧМН: без видимой очаговой патологии. Мышечный тонус снижен в нижних конечностях. Сухожильные рефлексы с рук S=D, с ног коленные рефлексы вызываются D<S, ахилловы не вызывается. Брюшные рефлексы сохранены. Анальный, подошвенный рефлексы практически не вызываются. Видимых координаторных нарушений нет. У ребенка отмечается гиперэластичность кожных покровов, слабость связочного аппарата. Чувствительность болевая и температурная снижены в области промежности, внутренней поверхности бедер, стоп, по сегментарно-периферическому типу. Тазовые функции нарушены: анус зияет, выпадение прямой кишки, энурез, энкопрез. Психомоторное развитие: ходит самостоятельно, походка «утиная». Гипотрофия мышц дистальных отделов нижних конечностей. Уровень развития мышления, речи, восприятия, коммуникации соответствует возрасту.
ЭЭГ: выраженные изменения с признаками дисфункции срединно-стволовых структур, преобладает медленно-волновая активность. Зарегистрированы острые волны по всем отведениям правого полушария. ЭНМГ: сегментарно-периферический тип нарушения с элементами переднероговой активности с уровня L4-5. Резкое снижение амплитуды кривой БА мышц нижних конечностей. Амплитуды М-ответов снижены при стимуляции nn.tibialisetperoneus, больше справа, что не позволило определить СПИэфф. Бульбокавернозный рефлекс практически не регистрируется.
Второй курс лечения прошла в 4 года: улучшилась походка, стала вставать на полную стопу, наросла сила в перонеальных мышцах, улучшилось смыкание ануса, уменьшились явления энуреза.
Рис. 17. Ильсия Г. Состояние после удаления спинномозговой грыжи поясничной локализации (менингомиелорадикулоцелле с перфорацией грыжевого мешка). Появление бульбокавенозного ответа на 4-ом курсе реабилитационной терапии с применением ТВМС.
Нейропсихологическое обследование выявило функциональную недостаточность в лобном, теменном, височном отделе левого полушария, что проявляется в нарушении реципрокной координации, произвольной регуляции движений, сужении объема памяти.
СПИэфф. по n.tibialis и n.peroneus стали определятся, хотя остается выраженное снижение амплитуды М-ответов при стимуляции n.tibialis и n.peroneus, больше справа. При трансвертебральной магнитной стимуляции поясничного отдела спинного мозга регистрируются низкоамплитудный ответ.
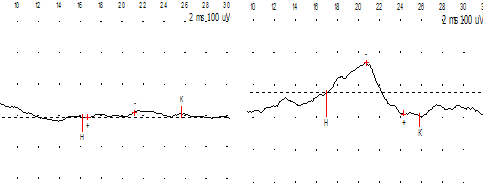
На четвертом курсе лечения (4 года 8 месяцев) улучшилась походка, стала кататься на велосипеде. Улучшилась трофика мышц промежности, анус сомкнут, выпадение прямой кишки наблюдается крайне редко, увеличился объем остаточной мочи, уменьшились явления недержания мочи и кала. Появились соматосенсорные ВП с обеих сторон. Удается определить СПИэфф. по периферическим нервам нижних конечностей. Впервые зарегистрирован низкоамплитудный бульбокавернозный рефлекс с амплитудой 1,34 мкВ (рис. 17).
Рис. 18. Ильсия Г. Состояние после удаления спинномозговой грыжи поясничной локализации (менингомиелорадикулоцелле с перфорацией грыжевого мешка). Появление на фоне реабилитационной терапии с применением лечебной ТВМС соматосенсорных ВП при стимуляции правого и левого большеберцовых нервов.
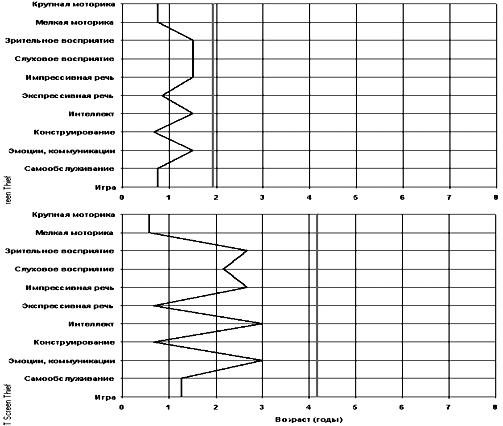
Профиль развития психоневрологических функций: выявлена положительная динамика в развитии крупной моторики (улучшилась походка, перешагивает препятствия, прыгает на двух ногах, катается на велосипеде, бегает), в мелкой моторике (улучшилась тонкая моторика пальцев, улучшилось рисование простого рисунка и копирование геометрических фигур). Развитие перцептивной, речевой, интеллектуальной и коммуникативной сфер соответствует возрастной норме.
К пятому курсу лечения (5 лет) значительно улучшилась походка, вертикализация тела, чувствительность в ногах и промежности, трофика мышц нижних конечностей и промежности. Значительно нивелировались явления энуреза и энкопреза. ЭНМГ: Соматосенсорные ВП: появление коркового ответа при стимуляции большеберцовых нервов с обеих сторон (рис. 18). При накожном отведении биопотенциалов мышц в нижних конечностях кривая низкоамплитудная, регистрируется переднероговая активность. В динамике – увеличение СПИэфф. по nn. tibialis и peroneus амплитуды М-ответов при стимуляции периферических нервов нижних конечностей. Бульбокавернозный рефлекс регистрируется хорошо, амплитуда его наросла.
Максим М. поступил на первый курс лечения в возрасте 9 месяцев. Диагноз: Перивентрикулярная энцефалопатия с гипоплазией лобного, височного отделов коры, мозолистого тела, червя мозжечка, ствола. Расширение желудочковой системы. Нарушение двигательного, психоречевого развития. Эпилептический синдром. ДЦП, спастический тетрапарез. Частичная атрофия зрительных нервов. Стволовой синдром. Миелодисплазия со слабостью анального сфинктера. Из анамнеза: ребенок от первой беременности, протекавшей на фоне хронического аднексита, герпетической инфекции, угрозы выкидыша на 3 месяце беременности. Роды срочные, слабость родовой деятельности. Состояние после рождения тяжелое, Апгар 4\7 баллов, вес при рождении 3900. Жалобы при поступлении: на задержку двигательного развития.
В неврологическом статусе: в сознании, активный, эмоционально откликаемый. Менингеальных знаков нет. Эпилептиформные приступы тонико-клонического характера ежедневно. Противосудорожную терапию до госпитализации не получал. ЧМН: легкое сходящееся косоглазие, иногда поперхивание при глотании, гиперсаливация, повышение небного рефлекса, нарушение жевания, выраженные оральные автоматизмы, гипертонус трапециевидных мышц. Стволовой синдром. Мышечный тонус повышен по спастическому типу в сгибателях верхних и нижних конечностях S=D, аддукторах, мышцах тазового пояса. Сухожильные рефлексы высокие, S=D. Кожные рефлексы сохранены. Патологические знаки положительные с двух сторон. Видимых координаторных нарушений нет. Психомоторное развитие: голову удерживает плохо, самостоятельно не сидит, не стоит, не ходит, опора на ноги на носки с перекрестом. Руками не манипулирует, захват в кистях рук плохой. Во время процедуры метамерной фармакотерапии обнаружено снижение болевой чувствительности в промежности, а также слабость анального сфинктера и снижение анального рефлекса.
Заключение психолога: выявлена задержка в развитии навыков крупной моторики (ребенок неуверенно держит голову, не поднимает голову в положении на животе, опора на носки, шаг с перекрестом), мелкой моторики (удерживает вложенную в руку игрушку, но не манипулирует ей); в перцептивном и эмоциональном развитии отставание от нормы заметно в меньшей степени (откликается на имя, дифференцированно реагирует на вербальные обращения), в активной речи отдельные лепетные слоги. Заключение логопеда: задержка психоречевого развития, оральный праксис нарушен, активная речь на уровне отдельных слогов, импрессивная речь относительно сохранна.
ЭЭГ: грубые изменения с преобладанием медленно-волновой активности, зарегистрирована эпилептическая активность по всем отведениям правого полушария и в затылочном отведении левого полушария в виде комплексов «пик-волна» с частотой 3 в сек. ЭНМГ: надсегментарный уровень нарушения регуляции мышечного тонуса (пирамидно-экстрапирамидная заинтересованность), акцент слева. Отмечается снижение СПИэфф. по нервам рук и ног.
Ко второму курсу лечения (1 год) уменьшилась спастика, улучшилась вертикализация, лучше держит голову, увеличился объем движений руками, улучшился захват. Понимает некоторые словесные инструкции. После первого курса лечения приступов судорог не было.
ЭЭГ: Диффузные изменения БЭА мозга резидуально органического характера, доминирует медленно-волновая активность тета- и дельта-диапазона. ЭНМГ: надсегментарный уровень нарушения со снижением амплитуды осцилляций. СПИэфф. несколько снижены, больше с ног. Параметры М-ответов в пределах возрастной нормы. Зрительные ВП: регистрируются с выраженным снижением амплитуды. Слуховые ВП: плохо дифференцированы, низкоамплитудные.
На 5-ом курсе лечения (1 год 11 месяцев) увеличился объем движений в руках, улучшилась трофика и моторика анального сфинктера, хотя бульбокавернозный рефлекс регистрируется с трудом, амплитуда его резко снижена (рис. 19).
Психологическое обследование выявило положительную динамику в развитии крупной моторики (улучшилась вертикализация, возросла двигательная активность, увеличился объем движения в плечевом поясе, улучшилась опора на стопы, уменьшился перекрест ног при ходьбе), в мелкой моторике (лучше захват предметов, лучше координация и зрительный контроль за движениями), в перцептивном и психоречевом развитии (узнает предметы и картинки по названиям, появились новые слоги, ребенок пытается отвечать на вопросы), эмоциональные реакции стали более дифференцированными.
ЭЭГ: выраженные диффузные изменения БЭА мозга с признаками дисфункции срединно-стволовых структур. На фоне ритмической фотостимуляции регистрируется билатеральные синхронные вспышки медленно-волновой активности, что может свидетельствовать о снижении порога судорожной готовности. Эпилептоидная активность не зарегистрирована. Зрительные ВП – в динамике отмечается улучшение ответа на зрительную стимуляцию. Слуховые и соматосенсорные ВП: регистрируются с выраженными отклонениями по амплитуде и латентности. ЭНМГ: в динамике увеличилась амплитуда М-ответов по нервам рук и ног. Бульбокавернозный рефлекс: отмечается нарастание амплитуды ответа (рис. 19).
К 8-му курсу лечения (4 года 2 мес) улучшилась вертикализация, лучше опора на стопы, уменьшился перекрест ног при ходьбе, лучше шаг, увеличился объем движений в руках, улучшилась мелкая моторика кистей рук, зрительное восприятие, понимание бытовой речи, выполнение простых инструкций, увеличилась речевая активность. Отмечено улучшение трофики мышц промежности, анус сомкнут, устойчиво вызывается анальный рефлекс.
Рис. 19. Максим М. ДЦП, спастический тетрапарез. Миелодисплазия со слабостью анального сфинктера. Динамика бульбокавернозного рефлекса на фоне реабилитационной терапии с применением лечебной ТВМС. Слева – пятый курс лечения (1 год 11 месяцев), справа – 8-ой (4 года 2 месяца).
Психологическое обследование выявило положительную динамику в развитии навыков крупной моторики (у ребенка улучшилась вертикализация и опора на ноги, уменьшился перекрест ног при ходьбе, стал лучше шаг, стал устойчивее сидеть на диване, увеличился объем движений в плечевом поясе), в мелкой моторике (пытается захватывать предметы с поверхности стола, уменьшилась спастика в кистях рук, лучше удерживает вложенные игрушки, при помощи взрослого собирает и разбирает пирамидку, рисует каракули), в зрительном восприятии (узнает себя и близких в зеркале, рассматривает фотографии, зрительно узнает много картинок, подбирает парные игрушки и картинки, зритрельно показывает части тела и лица), в импрессивной речи (улучшилось понимание бытовой речи и несложных рассказов, лучше выполняет инструкции), в экспрессивной речи (увеличилась речевая активность, пытается повторять за взрослым слоги), в интеллектуальной сфере (различает и показывает «большой-маленький», знает основные цвета, узнает картинки с простыми действиями), улучшился эмоциональный фон, стал более активным при общении, научился самостоятельно держать бутылку, из которой пьет, мимикой показывает согласие и несогласие (рис. 20).
Рис. 20. Максим М. ДЦП, спастический тетрапарез. Миелодисплазия со слабостью анального сфинктера. Динамика бульбокавернозного рефлекса на фоне реабилитационной терапии с применением лечебной ТВМС. Слева – пятый курс лечения (1 год 11 месяцев), справа – 8-ой (4 года 2 месяца).
ЭЭГ: умеренно выраженные диффузные изменения биоэлектрической активности мозга, с признаками обеднения корковой ритмики, десинхронизацией и сглаженностью зональных различий. В динамике отмечается редукция эпилептиформной активности. Зрительные ВП: регистрируются ранние и поздние компоненты ответа, хотя латентности увеличены с обеих сторон. Слуховые ВП: при стимуляции каждого уха выделяются все основные компоненты ответа, однако, увеличены латентности 3 и 5 справа, МПИ 3-5 слева, и все МПИ справа. Соматосенсорные ВП: при стимуляции срединных нервов выделяются с двух сторон только периферический и шейный компоненты. ЭНМГ: при накожном отведении биопотенциалов мышц верхних и нижних конечностей определяется кривая интерференционного типа, разреженная, с элементами залповой активности, амплитуда кривой снижена в нижних конечностях. Бульбокавернозный рефлекс регистрируется.
Таким образом, диагностическое применение ТВМС при миелодисплазиях с тазовыми нарушениями более эффективно, по сравнению определением БКР, амплитуда потенциала которогопри энурезе и энкопрезе обычно значительно снижена или ответ БКР совсем не регистрируется. В динамике восстановления тазовых функций на фоне терапии целесообразно сопоставлять ответы, вызванные ТВМС и БКР, что позволяет проследить этапы улучшения и обосновывать прогноз.
Отмечена определенная эффективность лечебного применения ТВМС при спинальных нарушениях. Магнитная стимуляция назначалась детям в комплексе реабилитационной терапии, а не в изолированном виде. Однако опыт ее применения свидетельствует о существенном вкладе лечебной ТВМС в суммарный эффект комплекса лечения, что позволяет рекомендовать ее более широкое использование у больных с нарушениями развития психоневрологических функций. Комплексная реабилитационная терапия, проводимая в НТЦ ПНИ, позволяет не только улучшить состояние больных, ускорить темпы психоневрологического развития по основным направлениям, но одновременно стимулирует развитие нейронов и их связей, косвенно компенсируя не только их функциональную недостаточность, но и структурные нарушения, обусловленные нейродисплазией.
Литература
- Бадалян Л.О., Скворцов И.А. Клиническая электронейромиография. - М. Медицина. 1986. 368 с.
- Гимранов Р.Ф. Транскраниальная магнитная стимуляция. М.: «Аллана», 2002, 164 с.
- Григорян А.В. с соавт. Клинико-электромиографический контроль эффективности медикаментозного лечения и иглотерапии невритов лицевого нерва. В кн.: Структурно-функциональные основы нервных и психических заболеваний, т.1. М., 1983, с.63-65.
- Мирошников М.М. Тепловидение и его применение в медицине. М.: Медицина, 1981. 225 с.
- Никитин С.С., Куренков А.Л.. Магнитная стимуляция в диагностике и лечении болезней нервной системы. М.: САШКО, 2003. – 378 с.
- Ройтман Г.В. Особенности тепловизионных изображений у больных с различными формами детского церебрального паралича. Альманах «Исцеление», вып. 2. М.: Тривола. 1995, с. 289-298.
- Скворцов И.А. Дизнейроонтогенетические аспекты систематизации детских церебральных параличей и других нарушений развития двигательных, перцептивных, интеллектуальных, речевых и коммуникативных функций. Альманах "Исцеление". М. Тривола. 1997, с. 15-31.
- Скворцов И.А. Нейроонтогенетические аспекты детской неврологической инвалидности и новые подходы к терапии. – Альманах «Исцеление». М. Тривола. 1993, с. 11-24.
- Скворцов И.А. Развитие нервной системы у детей (нейроонтогенез и его нарушения). – М.: «Тривола», 2000. – 208. с.
- Скворцов И.А. Роль перивентрикулярной области мозга в нейроонтогенезе (в норме и при детском церебральном параличе). Альманах “Исцеление”, вып.2. М., Тривола, с. 38-61.
- Скворцов И.А. Электронейромиография. Методика. Динамика показателей в онтогенезе. В кн.: Клинико-электронейромиографическое изучение нервно-мышечных заболеваний и синдромов. Труды 2-го МОЛГМИ. М. 1981, с.37-67.
- Скворцов И.А., Тарасова О.Н. Успешное лечение поражений лицевого нерва методом метамерной фармакотерапии. Материалы российского конгресса “Новые технологии в неврологии и нейрохирургии на рубеже тысячелетий”. Ступино, 1999, с.179.
- Скворцов И.А., Хавхун Л.А., Устинова Е.В., Ильин Л.Б. Комплексная стимуляция статикомоторного и психоречевого развития детей с перинатальными поражениями центральной нервной системы. Ж. невропатологии и психиатрии им. С.С.Корсакова, 1989, 89, 8, с.23-27.
- Холодов Ю.А., Лебедева Н.Н. Реакции нервной системы человека на электромагнитные поля. М., Наука, 1992, с. 135.
- Чутко Л.С., Кропотов Ю.Д., Яковенко Е.А., Сурушкина С.Ю.. Транскраниальная микрополяризация при лечении синдрома нарушения внимания с гиперактивностью у детей и подростков. Российский вестник перинатологии и педиатрии, 2002, № 4.
- Шаховский В.А., Скворцов И.А., Харина Г.В. Клинико-электронейромиографическая характеристика миелодисплазий у детей. Ж. невропатологии и психиатрии им. С.С.Корсакова, 1987, вып.10, с. 1493-1496.
- Юрков Ю.А., Волкова Л.Д., Комолова Т.И., Сафонова Т.Я. Показатели обмена липидов при детском церебральном параличе. Педиатрия, 1980, 10, с. 58-60.
- Antal A., Kincses T.Z., Nitsche M.A. Pulse configuration–dependent effects of repetitive transcranial magnetic stimulation on visual perception. Neuroreport., 2002, V. 13(17), p.2229–2233
- Bartolomei F., Gavaret M., Dravet C. et al. Late-onset epilepsy associated with regional brain cortical dysplasia. Eur. Neurol., 1999, 42, 1, 11-16.
- Brett E.M. Paediatric Neurology. 1983. - P. 397-429.
- Burt T., Lisanby S.H., Sackeim H.A. Neuropsychiatric applications of transcranial magnetic stimulation. 2002; 5: 73-105.
- Cohen E., Bernardo M., Masana J., Arrufat F.J., NavarroV., Valls-Sole J., Boget T., Barrantes N.. Catarineu S., Font M. Repetitive transcranial magnetic stimulation in the treatment of chronic negative schizophrenic: a pilot study. J. Neurol. Neurosurg. Psychiatry 1999; 67: 129-130.
- Epstein C.M. Localizing the site of magnetic brain stimulation in humans. Neurology 1990; 40: 666-670.
- Fernandez E., Alfaro A., Tormos J.M., Climent R., Martinez M., Vilanova H., Walsh V., Pascual–Leone A. Mapping of the human visual cortex using image–guided transcranial magnetic stimulation. Brain Res. Brain Res. Protoc., 2002, V.10(2), p.115–124.
- Garaizar Axpe C., Perez Garcia J., Gil Anton J., Prats Vinas J.M. Frequency and current clinical diversity of cerebral cortical dysgenesis. An.Esp.Pediatr., 1998, 48,5,499-504.
- George M.S., Wassermann E.M., Williams W.A., Callahan A., Ketter T.A., Busser P., Hallett M., Post R.M. Daily repetitive transcranial magnetic stimulation (rTMS) improves mood in depression. Neuroreport 1995; 6: 1853-1856.
- Grisaru N., Chudakov В., Yaroslavsky Y., BelmakerR.H. Transcranial magnetic stimulation in mania: a controlled study. Am. J. Psychiatry 1998; 155: 1608-1610.
- Hamaguchi H., Hashimoto T., Mori K. et al. Moebius syndrom: continuous tachypnea verified by a polygraphic stugy. Neuropediatrics, 1993, 24,6,319-323.
- Hoffman R.E., Boutros N.N., Hu S., Berman R.M., Krystal J.H, Charney D.S. Transcranial magnetic stimulation and auditory hallucinations in schizophrenia. Lancet 2000; 355: 1073-1075.
- Homberg V., Netz J. Generalised seizures indused by TMS. The Lancet, 1989, р.1223.
- Hotson M. Transcranial magnetic stimulation of extrastriate cortex degrades human motion direction discrimination.Vis.Res., 1994, V.34, pp.2115–2123.
- Kamitani Y., Shimojo S. Manifestation of scotomas created by transcranial magnetic stimulation of human visual cortex.Nature Neuroscience, 1999, v.2, №8, pp.769–771.
- Kastner S., Demmer I., Ziemann U. Transient visual field defects induced by transcranial magnetic stimulation over human occipital pole.Exp. Brain Res., 1998, v.118, pp.19–26.
- Kimbrell T.L., Little J.T., Dunn R.T, Frye M.A., Greenberg B.D., Wassermann E.M., Repella J.D., Danielson A. L., Willis M.W., Benson B.E., Speer A.M., Osuch E., George M.S., Post R.M. Frequency dependence of antideprcssant response to left prc-frontal repetitive transcranial magnetic stimulation (rTMS) as a function of baseline cerebral glucose metabolism. Biol. Psychiatry 1999; 46: 1603-1613.
- Lefaucheur I.P., Drouot X., Keravel Y., Nguyen I.P. Pain relief induced by repetitive transcranial magnetic stimulation of precentral cortex. Ncurorcport 2001b; 12(13): 2963-2965.
- Lipson A.H., Gillerot Y., Tannenberg A.E., Giurgea S. Two cases of maternal antenatal splenic rupture and cerebral palsy in offspring. Further evidence for a utero placental vascular aetiology for the Moebius syndrome and some case of cerebral palsy. Eur.J.Pediatr.,1996,155,9,800-804.
- Lisanby S.H. Focal brain stimulation with repetitive transcranial magnetic stimulation (rTMS): implication for-neural circuity ofvdepression. Psychological Mcdccinc 2003; 33: 7-13.
- Marg E., Rudiak D. Phosphenes induced by magnetic stimulation over the occipital brain: description and probable site of stimulation. Optom. Vis. Sci., 1994, V.71, pp.301–311.
- Marg E., Rudiak D. Phosphenes induced by magnetic stimulation over the occipital brain: description and probable site of stimulation. Optom. Vis. Sci., 1994, V.71, pp.301–311.
- Marin-Padilla M. Developmental neuropathology and impact of perinatal brain damage. III: grey matter lesions of the neocortex. J.Neuropathol. Exp.Neurol., 1999,58,5,407-429.
- Martin J.L, Barbanqj M.J., Schlaepfer Т.Е., Clos S., Perez V., Kuliscvsky J., Gironell A. Transcranial magnetic stimulation for treating depression. Cochranc Database Systematic Review 2002; CD003493.
- Migita K., Uozumi Т., Arita K., Monden S. Transcranial magnetic coil stimulation of motor cortex in patients with central pain. Ncurosurgcry 1995; 36(5): 1037-1039.
- Mottaghy F.M., Keller C.E., Gangitano M., Ly J., Thall M., Parker J.A., Pascual-Leone A. Correlation of cerebral blood flow and treatment effects of repetitive transcranial magnetic stimulation in depressed patients. Psychiatry Res. 2002; 115(1-2): 1-14.
- Murray N.M.F. Magnetic Stimulation of cortex: clinical applications. J.Clin. Neurophysiol, 1991, v.8(1), pp.66–76.
- Nielsen J.F., Sinkjaer T. Long-lasting depression of solcus fnotoncurons excitability following repetitive magnetic stimuli of the spinal cord in multiple sclerosis patients. Multiple Sclerosis 1997; 3(1): 18-30.
- OliveroA., DiLazzara V., Piazza O., Prof ice P., Pennisi M.A., Della Corte F., Tonali P. Cerebral blood flow and metabolic changes produced by repetitive magnetic brain stimulation. J. Ncurol. 1999; 246: 1164-1168.
- Onuma A., Kobayashi Y., Iinuma K. The relationship between MR images and clinical findings in neuronal migration disorders. No To Hattatsu.,1997,29,4,285-290.
- Padberg F, Zwanzger P., Keck M.E., Kathmann N.. Mikhail P., Ella R., Rupprecht P., Thoma K, Hampel H., Toschi N., Moller H.J. Repetitive transcranial magnetic stimulation (rTMS) in major depression: relation between efficacy and stimulation intensity. Ncuropsychopharmacology 2002; 27(4): 638-645.
- Schule K. Klin. Paediat. – 1985. Vol. 197. N 4. – P. 277-281.
- Sebire G., Husson B., Dusser A. et al. Congenital unilateral perisylvian syndrome: radiological basis and clinical correlations. J. Neurol. Neurosurg. Psychiatry. 1996,61,1,52-56.
- Shimizu H., Tsuda Т., Shiga Y., Miyazawa K., Onodera Y., Matsuzaki M., Nakashima I., Furukawa K., Aoki M., Kato H., Yamazaki Т., Itoyama Y. Therapeutic efficacy of transcranial magnetic stimulation for hereditary spinocerebellar degeneration. Tohoku J. Exp. Mcd. 1999; 189:203-211.
- Svennerholm L., Vanier M.T. - Advanc. exp. Med. Biol.,1978,v.100, p.651.
- Valzania F., Quatrale R., Strafella A.P., Bombardi R., Santangelo M., Tassarini C.A. Pattern of motor evoked response to repetitive transcranial magnetic stimulation. EEG Clin. Neurophysiol. 1994; 93: 312-317.
- Vittek J., Winik A., Sioris C. et al. Analysis of orthodontic anomalies in mentally retarded developmentally disabled (MRDD) persons. Spec. Care. Dentist. 1994, 14,5,198-202.
- Yaroslavsky Y., Grisaru N., Chudakov В., Belmaker R.H. Is TMS therapeutic in mania as well as in depression? In: Transcranial magnetic stimulation. EEG Clin. Neurophysiol. 1999;51(Suppl.): 299-303.
- Ziemann U., Paulus W., Rothenberger A. Decreased motor inhibition in Tourettc's disorder: evidence from transcranial magnetic stimulation. Am. J. Psychiatry 1997; 154: 1277-1284.
Оглавление |
